DIY: EXPERIMENTO DE ÓSMOSIS
Cuando estudiamos la ósmosis en clase parece que son conceptos muy teóricos y que poco tienen que ver con nosotros.
En esta entrada os propongo un reto, vamos a trabajar estos fenómenos en la cocina de nuestras casas, esto nos ayudará a comprender los que sucede en nuestras células.
MARCO TEÓRICO
La ósmosis un proceso muy importante tanto a nivel químico como biológico. La ósmosis es un fenómeno en el que se produce el paso o difusión de un disolvente a través de una membrana semipermeable, la cuál permite el paso del disolvente pero no el del soluto, desde una disolución más diluida a otra más concentrada.
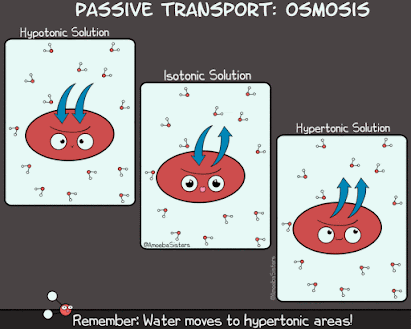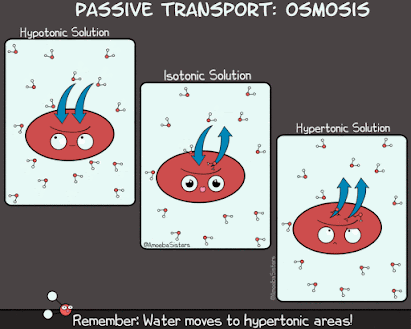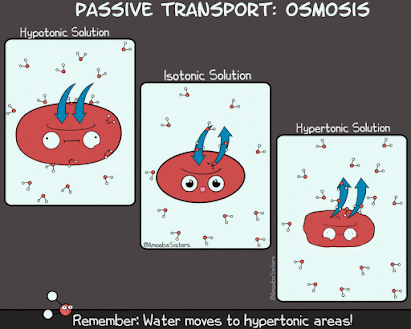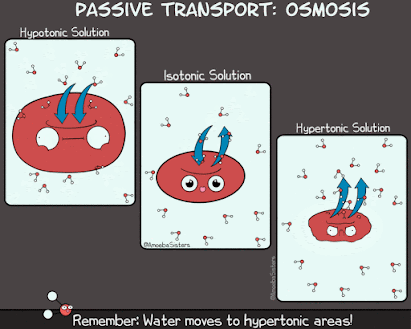
Las células son muy sensibles a la concentración de solutos del medio en el que se encuentran inmersas. De tal manera que nos podemos encontrar ante estas tres situaciones:
- La célula se encuentra inmersa en un medio cuya concentración salina es inferior a la suya, se encuentra en un medio hipotónico. El agua entrará a la célula ya que el potencial hídrico es más alto en el exterior. El resultado será que la célula se hinchará.
- Si introducimos a la célula en un medio en que la concentración salina sea mayor, un medio hipertónico,se producirá la salida de agua del interior celular.
- Si la célula se encuentra en un medio cuya concentración salina es igual a la suya, hablaremos de un medio isotónico, y no se producirá un movimiento netos de agua.
Las moléculas de agua difunden desde los medios hipotónicos hacia los hipertónicos provocando un aumento de la presión sobre la cara de la membrana del compartimento hipotónico, denominada presión osmótica. Como consecuencia del proceso osmótico se puede alcanzar el equilibrio, igualándose las concentraciones, y entonces los medios serán isotónicos, es decir que tienen la misma concentración.
Recalcamos, la ósmosis es un caso particular de difusión, es la difusión de agua, y únicamente agua, a través de una membrana semipermeable desde una zona de menor concentración de soluto hacia una zona de mayor concentración de ese soluto con el objetivo de igualar concentraciones.
Imagen sacada de :http://www3.gobiernodecanarias.org/medusa/ecoblog/ncarroq/2014/11/09/404/Si quieres profundizar en el concepto de ósmosis te recomiendo leer la entrada de este blog "Bioquímica 1".
DIY: PONIENDO EN PRÁCTICA LO APRENDIDO
Vamos a hacer un sencillo experimento en la cocina de nuestra casa. Para ello necesitaremos:
Materiales
- Patata cruda.
- Cuchillo y cuchara.
- Sal.
- Agua.
- Dos vasos.
Procedimiento
- Prepara dos vasos de agua.
- En uno de los vasos añade 2 cucharaditas de sal y remueve para que se disuelva mejor.
- Pela la patata y corta dos tiras de aproximadamente el mismo tamaño. Examina su flexibilidad.
- Coloca una tira de patata en cada vaso.
- Déjalas
en remojo durante varias horas. Mientras, saca las tiras de vez en cuando y
observa los cambios que se van produciendo en cuanto a tamaño, color y
flexibilidad.Horas después observaremos grandes cambios. Una ha aumentado de tamaño y la otra ha menguado. ¿Cómo podemos explicarlo?. ¿Te atreves a dar una explicación?.
EXPLICACIÓN
Cada célula que compone la patata está rodeada de una membrana protectora que deja pasar solamente ciertas sustancias, por eso se dice que es selectivamente permeable o semipermeable. El agua puede pasar por ósmosis a través de esta membrana.
Tira de patata en agua salada. Fuera de sus células, la concentración de sal es mucho mayor que dentro, así que el agua sale de la patata. Al perder agua, su tamaño disminuye y sus células empiezan a morir y a perder su rigidez. La tira de patata se vuelve elástica y su color se ennegrece.
Tira de patata en agua. Dentro de sus células, la concentración de sal es mayor que fuera. El agua entra para igualar concentraciones. Con tanta agua su tamaño y rigidez aumentan. Al intentar doblarla se parte.
TE RETO
Una vez que hemos hecho este experimento os reto con el siguiente:
No somos conscientes pero podemos ver la ósmosis en nuestra cocina: cuando hervimos pasta o arroz, cuando preparamos papas arrugadas, al poner hojas de lechuga o legumbres de remojo
Si ponemos una hoja de lechuga seca en agua, ésta recupera en unas cuantas horas toda su textura. La lechuga había perdido el agua, y la recupera gracias a la ósmosis.
Materiales
- dos huevos de gallina,
- vinagre
- Dos vasos en los que prepararás dos disoluciones: una muy concentrada en algún soluto (por ejemplo sal) y otra con únicamente agua destilada (si no tienes, puedes usar agua del grifo).
LA ÓSMOSIS EN NUESTRAS CÉLULAS
¿Qué os ha parecido?. ¿Me aceptas el reto e investigas y experimentas en tu casa?. Espero tus resultados y comentarios 😊
¡RETO ACEPTADO Y SUPERADO!
Henar ha aceptado el reto y lo ha superado. En este vídeo nos muestra sus resultados y conclusiones. ¡Muchísimas gracias!.






No hay comentarios:
Publicar un comentario